医药网5月26日讯 2020 年 5 月 14 日,注射剂一致性评价正式启动,意料之中的事情似乎并不意外,只是给国内众多注射剂文号持有企业吃了一颗定心丸。
注射剂一致性评价目前启动率仅3%
据 Insight 数据库统计,以剂型为注射剂、注射用微球、注射用脂质体、注射用乳剂、注射用微乳,上市文号在使用,药品类型为化学仿制药,搜索上市药品数据库,共有 30667 个文号(涉及企业 1000 家)需要开展一致性评价(未剔除氯化钠注射液等不需要开展一致性评价的品种);截止 5 月 14 日,已通过/视同通过一致性评价、递交补充申请、BE 试验中、备案参比和申报参比的共有 1010 个(按文号统计),注射剂一致性评价的启动率仅 3% 左右。
或许之前因为技术文件未公布、参比制剂未公布,企业迟迟不肯动工,但是据 Insight 数据库统计(https://db.dxy.cn/v5),目前在国家药监局已发布的正式版的参比制剂目录中,筛选剂型为注射剂、注射用微球、注射用脂质体、注射用乳剂、注射用微乳,共包括 849 个注射剂参比制剂,其中也包括一些特殊注射剂。所以,万事俱备只欠东风,注射剂仿制药淘汰赛开始加速。
图片来源:Insight 数据库
31 个品种通过/视同通过一致性评价
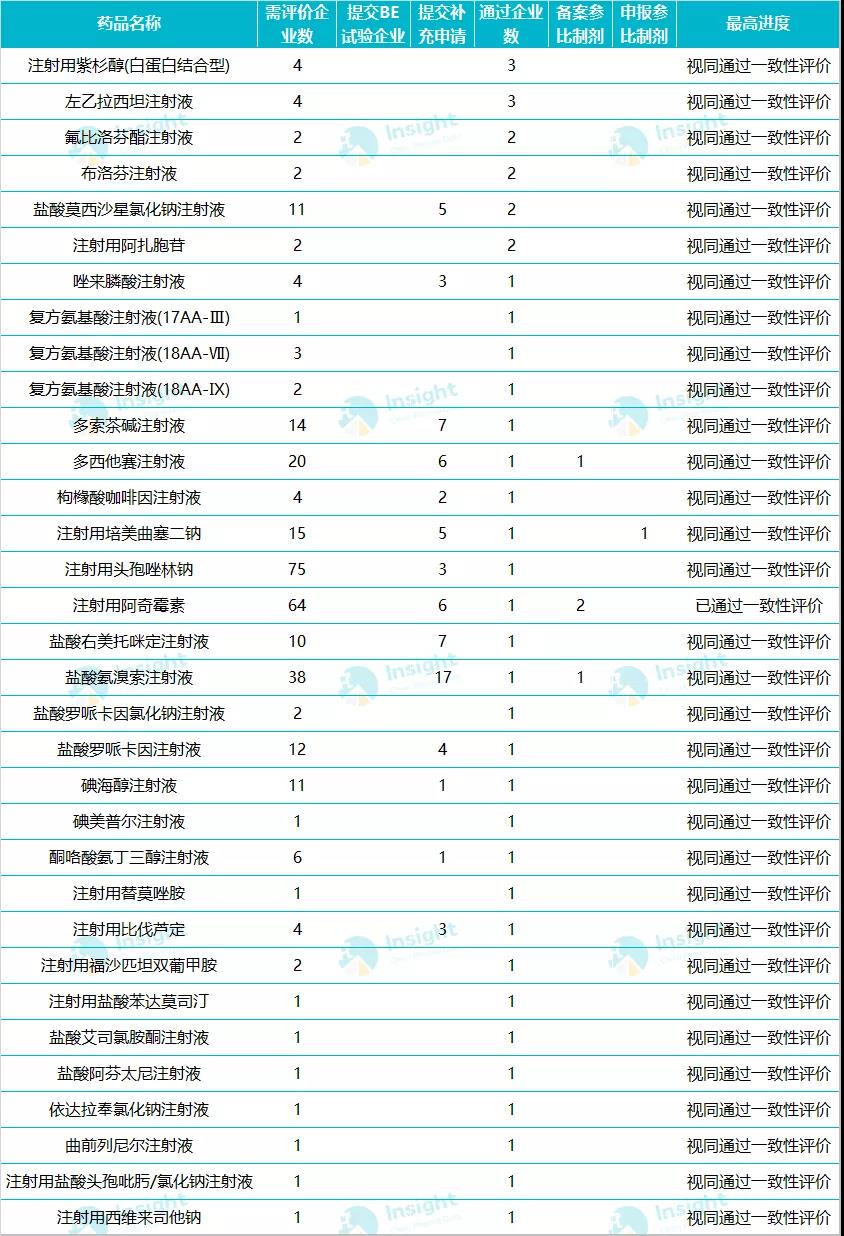
在目前已过评的 31 个注射剂品种中,只有海南普利制药的注射用阿奇霉素通过一致性评价,其余均为视同通过;且这 31 个品种中已有注射用培美曲塞二钠、氟比洛芬酯注射液、右美托咪定注射液、注射用紫杉醇(白蛋白结合型)进入国家带量采购。
数据来源:Insight 数据库
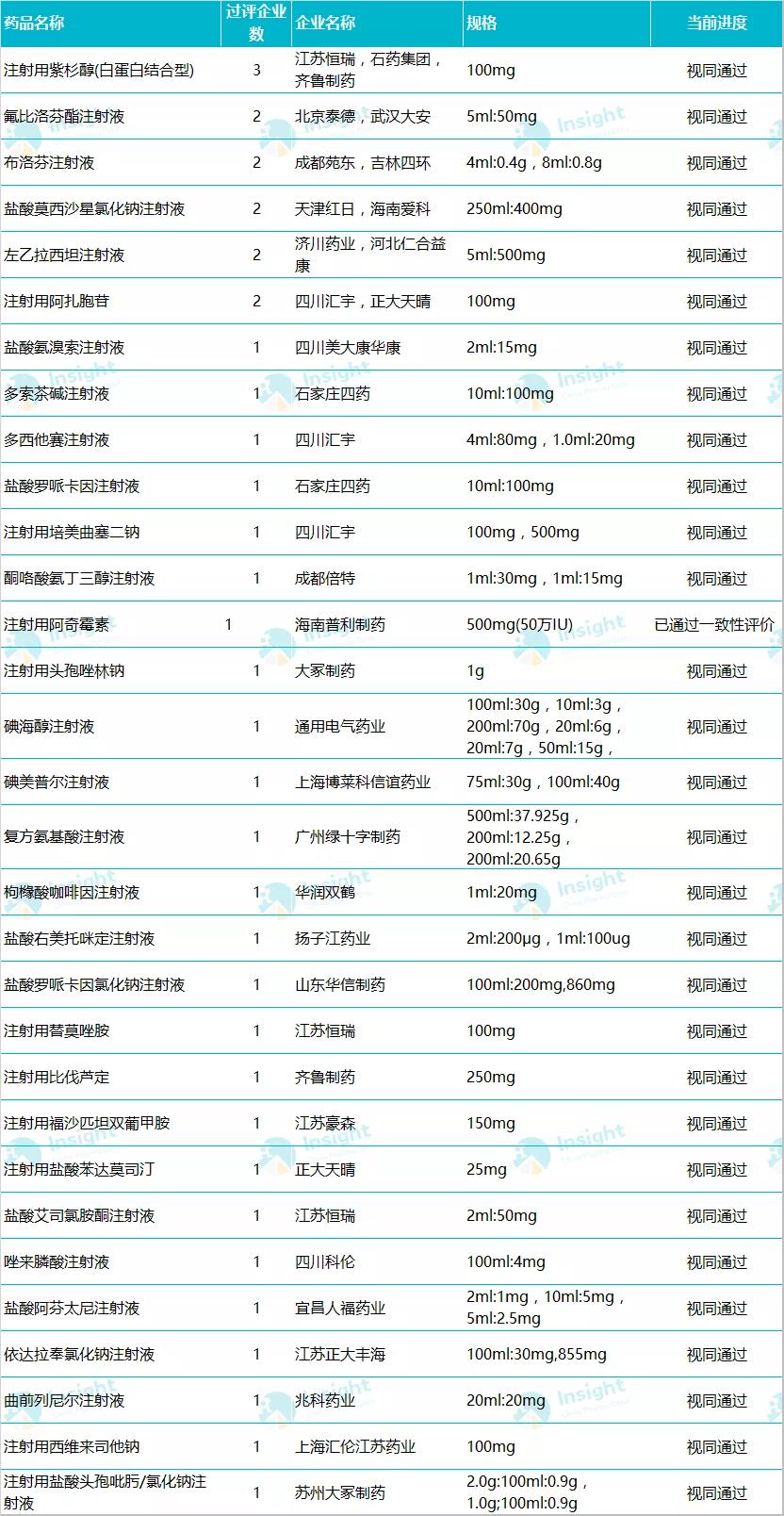
过评品种详情▼
备注:数据库显示 33 个品种,是按照药品名称统计,此处复方氨基酸注射液 Ⅲ、Ⅸ、Ⅶ 3 个规格统计为 1 个品种。
135 个品种已递交补充申请,是通过还是驳回?
在 Insight 数据库申报进度库中,筛选剂型为注射剂、注射用微球、注射用脂质体、注射用乳剂、注射用微乳发现,目前递交一致性评价补充申请的共有 723 个受理号(涉及品种 135 个),其中 1 个已获批通过一致性评价(海南普利的注射用阿奇霉素),1 个批准开展临床(广东嘉博制药的丙泊酚中/长链脂肪乳注射液),最要紧的是还有 718 个受理号递交注射剂一致性评价补充申请后尚未取得审评结论。
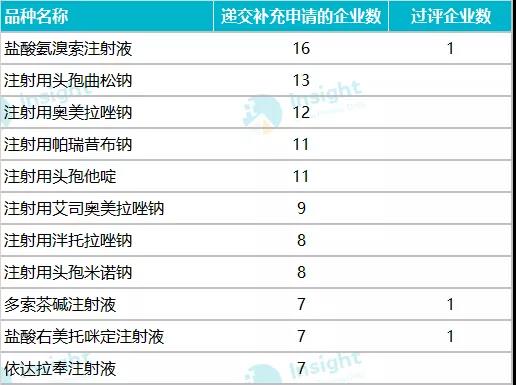
递交一致性评价补充申请最多的品种
数据来源:Insight 数据库
在这 718 个受理号中,最早的是在 2018 年递交一致性评价补充申请,但当时,注射剂一致性评价尚处于征求意见阶段,对于此阶段企业开展的注射剂一致性评价,国家药监局如何做审评结论我们也十分期待。
早在 2017 年 12 月,CDE 发布《已上市化学仿制药(注射剂)一致性评价技术要求》并公开征求意见;
2019 年 3 月 28 日,在 CDE 发布的第 21 批参比制剂目录中,首次出现注射剂参比制剂,共包括 224 个,一是引起业内骚动;
2019 年 10 月,国家药监局发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》和申报资料征求意见稿;
2019 年 11 月,CDE 又公布《特殊注射剂质量和疗效一致性评价技术要求(征求意见稿)》;
2020 年 5 月 14 日,注射剂一致性评价技术文件落地,标志着注射剂一致性评价全面启动。
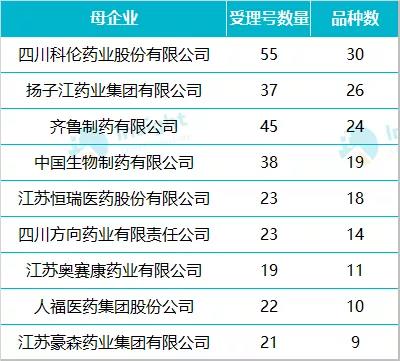
在 718 个递交一致性评价的受理号中,数量较多的企业有科伦药业、扬子江、齐鲁制药、中国生物制药、恒瑞等,涉及品种均超过 10 个。
数据来源:Insight 数据库
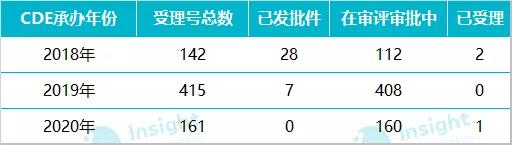
按照 CDE 承办的时间来看,2018 年承办的受理号共 142 个,2019 年承办 415 个;按照国家药监局最新发布的《关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》要求:审评工作应当在受理后 120 日内完成。经审评认为需申请人补充资料的,申请人应在 4 个月内一次性完成补充资料。发补时限不计入审评时限。由此看来,2018 年和 2019 年承办的一致性评价补充申请近期可能会拿到审评结论。
数据来源:Insight 数据库
免做一致性评价品种,已有企业申报补充申请
在 5 月 14 日 CDE 公布的《化学药品注射剂仿制药质量和疗效一致性评价技术要求》中明确:氯化钠注射液、葡萄糖注射液、葡萄糖氯化钠注射液、注射用水、部分放射性药物(如锝〔99mTc〕)等品种无需开展一致性评价,需进行质量提升研究,灭菌工艺、滤器与包材选择(含相容性研究)等应符合相关技术要求。
Insight 数据库显示,在已经递交一致性评价补充申请的品种中,涉及氯化钠注射液、葡萄糖氯化钠注射液、复方氯化钠注射液共有 12 个受理号,包括企业有科伦药业、山东齐都药业、石家庄四药等。不过数据库中未查到这些品种有开展过生物等效性试验。
数据来源:Insight 数据库
整体来说,注射剂一致性评价尚在早期,过评品种较少,如果能够把握好时间首家过评,就有可能重演扬子江药业右美托咪定注射液在 4+7 集采中的辉煌,逆袭甚至扭转市场格局;当然,也有可能在集采中沦为炮灰,但是长远来看,不做连上战场的机会都没有。
一致性评价就是一场博弈。
(以上信息来源于医药网)

 琼公网安备 46010602000893号
琼公网安备 46010602000893号
