医药网5月22日讯
5月20日,国务院新闻办公室举办新闻发布会,会议上,中国工业和信息化部新闻发言人黄利斌介绍,医用防护服日产量由最初的不足1万件上升到70多万件;国内红外温度传感器日均交付量由非疫情期间的1.5万颗扩大到50万颗。
黄利斌介绍,疫情发生以来,累计向湖北供应调运医用防护服达到770多万件,隔离衣、手术衣达到280多万件,医用隔离眼罩面罩达到160多万个,消杀用品达到2200多吨,红外测温仪近70万台,医疗设备达到8万台(套)。
目前海外疫情仍然十分严峻,疫情防控的需求大大加速了医疗器械在全球范围内的流通,同时,也使医疗器械的溯源监管显得格外重要。
目前,我国医疗器械唯一标识数据库正式对外开放共享,公众、医疗器械企业和医疗机构等都可查询使用。
不仅如此,今年10月,国家药监局将组织开展心脏起搏器、冠脉支架等9大类64个医疗器械品种的唯一标识实施工作。
这意味着,我国的第一批医疗器械“电子身份证”将落地,落地后每个医疗器械都将能追根溯源,实名制。
一械一码一身份
医疗器械的“电子身份证”就是医疗器械唯一标识(Unique Device Identification,简称UDI)。
此前,医疗器械在流通使用环节无码或者一物多码现象普遍,严重影响了医疗器械生产、流通、使用等各环节对医疗器械的精准识别,难以实现有效监督和管理。
而实施UDI后,则有望实现“一械一码一身份”,从源头生产、经营流通、到临床使用各环节“一码联通”。
我国在2019年明确提出“制定医疗器械唯一标识系统规则”,随后,《医疗器械唯一标识系统试点工作方案》、《医疗器械唯一标识系统规则》、《关于做好第一批实施医疗器械唯一标识工作有关事项的通告》等一系列相关政策文件密集出台,提出用2019年7月到2020年7月一年的时间,实施医疗器械唯一标识试点工作。
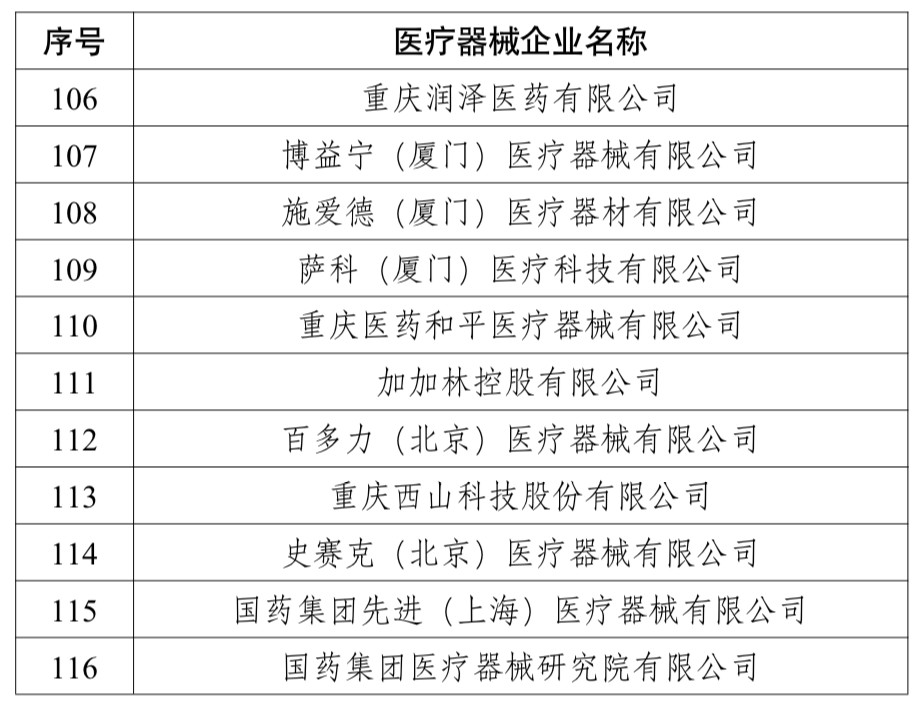
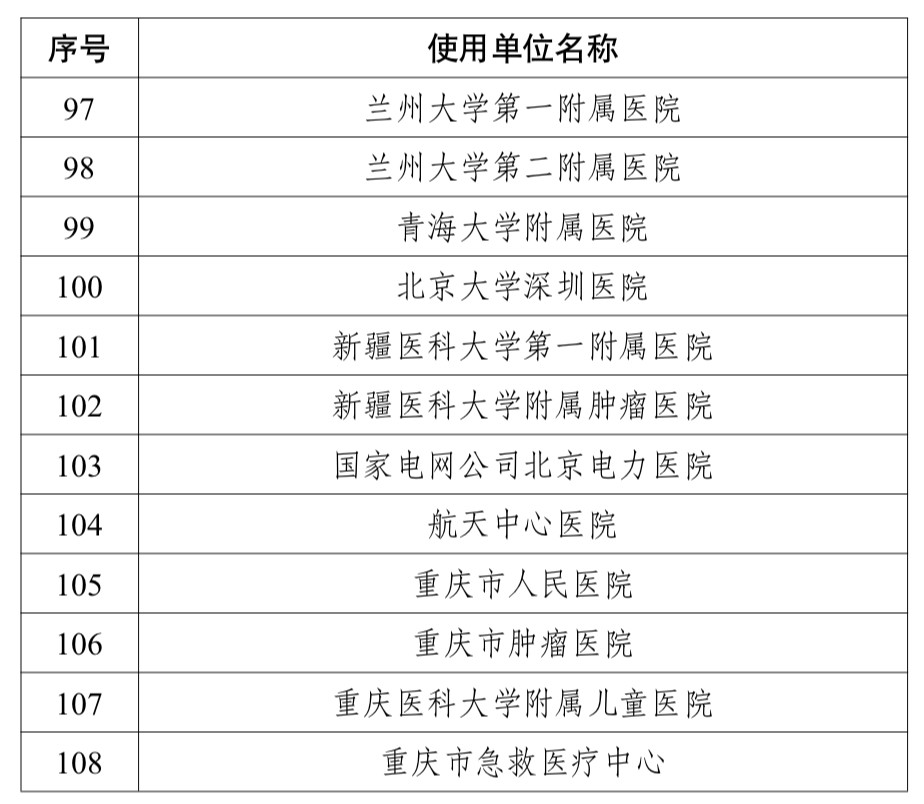
参与试点的单位即涵盖了北京大学第一医院等全国108家医疗机构和国药集团医疗器械研究院有限公司等116家医疗器械企业。
医疗器械生产经营企业可查询
而要推进UDI试点应用,实现数据的汇聚和共享是重要前提,为此,国家药监局统筹建设了医疗器械唯一标识数据库,收集产品标识(DI)及相关数据;
同时制定了《医疗器械唯一标识数据库基本数据集》《医疗器械唯一标识数据库填报指南》2项标准。
据了解,在数据库建设的前期,国家药监局做了大量的调研论证工作,在制定标准过程中组织生产企业、经营企业、医院、发码机构等单位人员组成专家组进行数据项把关。
在多次征求意见后,以期贴合企业和使用单位的实际需求,同时兼顾国际上的通用做法,使我国医疗器械的唯一标识符合“国际语言”的标准。
2019年12月10日,医疗器械唯一标识数据库正式上线,并对试点企业开启申报功能。
3月31日,数据库进一步开放数据库共享功能,以查询、下载、接口对接等三种方式,供公众、医疗器械生产经营企业和医疗机构等各方查询使用。
2019年12月至2020年6月仅对试点企业开放数据申报功能。
9大类64个医疗器械品种
医疗器械唯一标识数据库上线后,来自试点企业的申报数据一直在不断增长,目前,已收集数据超过2.43万条,其中92.34%为器械类产品,7.66%为体外诊断试剂类产品。
国家药监局表示,医疗器械唯一标识的推进工作已被列入国家药监局2020年重点工作,特别是10月起,将组织开展9大类64个医疗器械品种的唯一标识实施工作,同步研究制定第二批实施品种和政策。
第一批实施唯一标识的64个品种包括心脏起搏器、血管支架、关节假体和整形填充材料等各种植入类产品,均为高风险第三类医疗器械。
按照《医疗器械唯一标识系统规则》,2020年10月1日以后的这64种医疗器械产品,必须具备医疗器械唯一标识,并在将相关数据上传至医疗器械唯一标识数据库,方可上市销售。
而在10月第一批UDI实施之前,针对相关方的宣传、培训、试点等各项准备工作也十分重要。国家药监局表示,接下来将持续加强宣贯培训,总结UDI试点工作经验,为UDI正式实施做好准备工作。
同时,将持续加强与国家卫生健康委、国家医保局的沟通协调,积极拓展UDI在医疗、医保工作中的应用,助推“三医联动”。
事实上,医疗器械唯一标识的实施,是对监管方、消费者、医疗机构和整个医疗器械产业发展多方利好的创新举措。
通过信息公开和数据共享,政府管理部门可实现透明溯源、智慧监管;医疗机构可以减少用械差错、提升相关管理水平。
附件1为试点企业名单、附件2为试点医院名单










(以上信息来源于医药网)

 琼公网安备 46010602000893号
琼公网安备 46010602000893号
