医药网5月20日讯 近日,造影剂领域制剂龙头恒瑞医药与原料药龙头司太立官宣合作,引发业内关注。紧接着,司太立首个造影剂制剂产品获批,恒瑞重新提交钆布醇注射液注册申请。米内网数据显示,2019年中国公立医疗机构终端造影剂销售额为152.10亿元,销售额超过10亿元的品牌有7个。随着司太立拿下首个过评造影剂,注射剂一致性评价正式开展,药品审评审批及国家集采提速,恒瑞营收超32亿元的造影剂将面临集采的挑战,与司太立的合作意图不言而喻。
恒瑞、司太立两大造影剂龙头抱团,意欲何为?
5月13日,恒瑞医药与司太立双双宣布将合作开拓碘造影剂领域市场。根据协议,司太立将负责研发并注册符合NMPA或其他领域内药品相关监管部门要求的合作产品(碘海醇注射液及碘帕醇注射液),恒瑞医药则负责对合作产品进行商业化运作,包括营销、自行或与经销商合作销售。双方按产品销售毛利进行五五分成,恒瑞医药对每个司太立获批上市的制剂产品支付500万元。
司太立是国内碘造影剂原料药龙头,主要产品有碘海醇、碘克沙醇、碘帕醇原料药及碘海醇水解物、碘佛醇水解物等中间体。2019年公司造影剂系列产品营业收入为11.65亿元,同比增长56.15%。此前,司太立已经向CDE提交碘海醇注射液、碘帕醇注射液、碘克沙醇注射液、碘佛醇注射液、碘美普尔注射液等5款造影剂的上市申请,公司将迎来制剂产品的密集收获期。
恒瑞医药是国内碘造影剂制剂龙头,公司已拥有碘克沙醇注射液、碘佛醇注射液、罂粟乙碘油注射液3款碘造影剂。2019年恒瑞医药造影剂营业收入为32.30亿元,同比增长38.97%,毛利率达72.94%。其中,碘克沙醇注射液销售量为369.34万支,同比增长49.11%。司太立一直是恒瑞碘克沙醇、碘佛醇原料药的核心供应商。
恒瑞钆布醇注射液注册申请情况
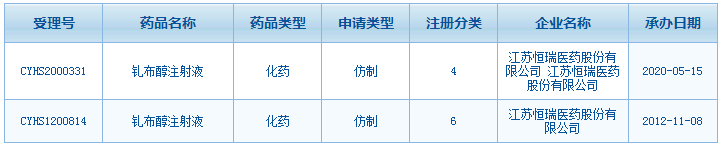
多年耕耘打下的造影剂市场,恒瑞医药持续的开拓防御自然少不了。新品开发方面,恒瑞医药计划收割的是钆布醇注射液,尽管该产品历时7年多的注册申请在今年4月被否,但恒瑞并不轻言放弃,5月15日该产品按仿制4类提交的注册申请获得CDE承办受理。面对仿制药集采的宿命,恒瑞医药的碘克沙醇注射液、碘佛醇注射液一致性评价补充申请在审中。此次与司太立的合作,更是以强强联合的方式实现原料药+制剂一体化,强化造影剂市场竞争力。
超150亿市场,扬子江、GE、恒瑞……TOP10品牌揭晓
中国公立医疗机构终端造影剂销售情况(单位:万元)
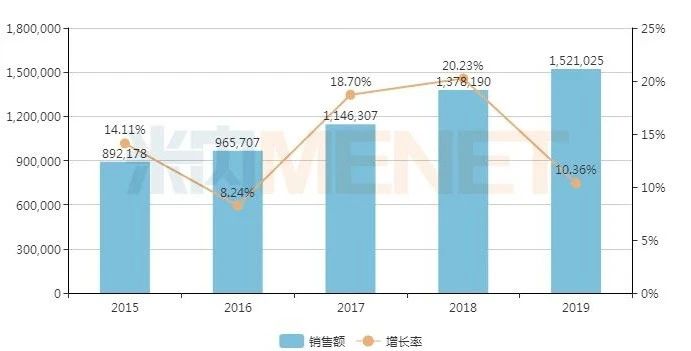
造影剂又称为对比剂,用于医学成像方面,可增强影像观察效果的对比度,主要应用于心血管、肿瘤等疾病。米内网数据显示,2019年中国城市公立医院、县级公立医院、城市社区中心以及乡镇卫生院(简称中国公立医疗机构)终端造影剂销售额为152.10亿元,同比增长10.36%。
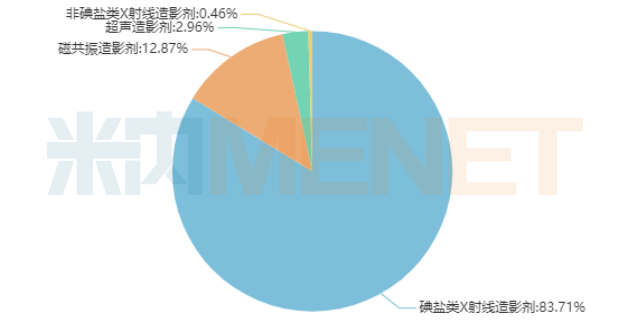
在中国公立医疗机构终端152.10亿元造影剂市场中,以碘海醇注射液、碘克沙醇注射液为代表的碘盐类X射线造影剂占据83.71%的市场份额,以钆喷酸葡胺注射液、钆双胺注射液为代表的磁共振造影剂占比12.87%,超声造影剂、非碘盐类X射线造影剂仅占据极小的市场份额。
2019年中国公立医疗机构终端造影剂类别格局
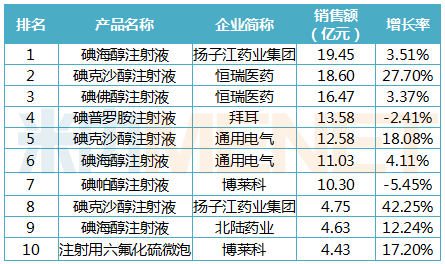
造影剂品牌TOP10中,7个品牌的销售额超过10亿元,扬子江药业集团、恒瑞医药、通用电气、博莱科均有2个品牌上榜。扬子江药业集团的碘海醇注射液(商品名欧苏)以19.45亿元的销售额位居榜首,碘克沙醇注射液则以42.25%的销售增长率领跑。博莱科的独家产品注射用六氟化硫微泡(商品名声诺维)成为唯一上榜的超声造影剂。通用电气的碘克沙醇注射液、碘海醇注射液销售额已分别被恒瑞、扬子江超越。
2019年中国公立医疗机构终端造影剂品牌TOP10
首个过评造影剂来了,集采还会远吗?
5月14日,NMPA官网显示,司太立按仿制4类提交的碘帕醇注射液上市申请(受理号CYHS1700386)已发送药品批件,批准文号为国药准字H20203203。这意味着造影剂原料药龙头司太立迎来首个制剂产品,同时,150亿市场首个过评造影剂诞生。
造影剂市场10亿单品并不少,然而过评品种仅有原料药龙头司太立刚刚获批视同过评的碘帕醇注射液。米内网数据显示,2019年中国公立医疗机构终端造影剂用药途径格局中,注射剂占据99.53%的市场份额。分析认为,造影剂过评少,一是受制于技术难度高、仿制药企少,二是受制于此前注射剂一致性评价政策的不明朗。
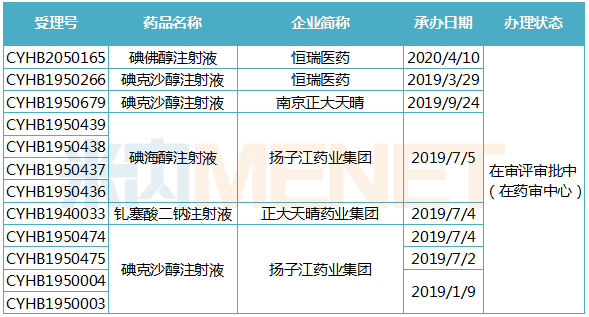
米内网一致性评价数据库显示,国内药企布局造影剂一致性评价时间并不算早。目前碘佛醇注射液、碘克沙醇注射液、碘海醇注射液、钆塞酸二钠注射液等4个注射剂品种一致性评价在审中,在审受理号的最早承办时间为2019年1月9日,主要布局企业有恒瑞、扬子江、正大天晴等。
造影剂一致性评价在审企业
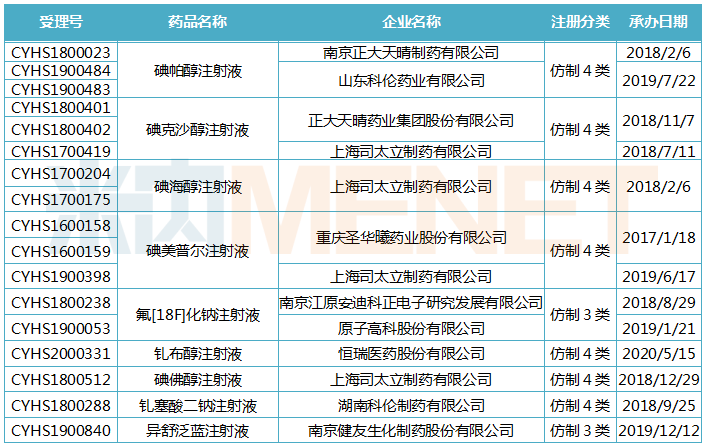
米内网数据显示,目前CDE承办受理的造影剂有9个品种(17个受理号)按新注册分类(仿制3、4类)提交上市申请,主要申报企业有司太立、正大天晴、科伦等。从审评时间看,多个受理号有望在下半年完成审评审批,获批后将视同通过一致性评价。
按新注册分类报产的造影剂
值得关注的是,5月14日,NMPA宣布启动注射剂一致性评价,审评时限为120天。这意味着,造影剂过评速度将加快,过评品种数量也将增加。与此同时,新一轮集采已经进入筹备阶段,造影剂受制于过评数量,短期内不会纳入国采。但随着注射剂一致性评价正式开展,医保控费的紧迫带来的集采提速,造影剂纳入集采只是时间上的博弈。
(以上信息来源于医药网)

 琼公网安备 46010602000893号
琼公网安备 46010602000893号
