2015年国务院发布《关于改革药品医疗器械审评审批制度的意见》,明确指出提高仿制药质量的目标。近年来,药品监管部门高度重视仿制药质量和疗效一致性评价(以下简称一致性评价)工作,过评药品品种数量、覆盖广度大幅提升,“跑”出了加速度。2021年,一致性评价工作扎实推进,成效明显。
本文结合国家药监局网站及药融云数据库相关数据,对2021年全年一致性评价情况进行分析发现,全年共有1972个品规的仿制药通过一致性评价(包含按化学药品新注册分类批准的895个品规仿制药),涉及571家医药企业,532个药品品种,其中有264个药品品种为首家过评。
补充申请数量逐年降低
企业着力于新注册分类药品申报
分析近三年来一致性评价补充申请和新注册分类申请受理情况,2019—2021年国家药监局药品审评中心一致性评价补充申请和新注册分类申请(仿制药3类/4类与进口药5.2类)情况呈现出完全相反的趋势(详见图1),补充申请量持续下降,2021年共受理891项,而新注册分类申请量持续上升,2021年达到1843项,同比增长63.39%。
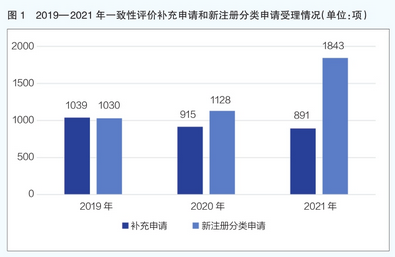
可以看出,仿制药企业的重心开始转移,从着力于新注册分类实施前上市药品的一致性评价转向开始重视发展高质量标准的新型仿制药研发。
注射剂过评药品占比显著提升行业竞争愈加激烈
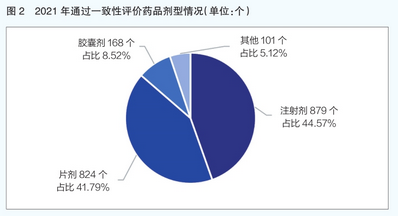
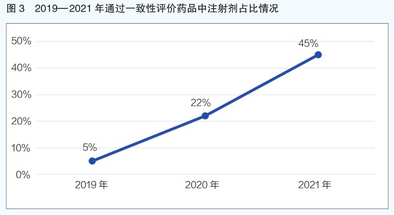
从过评药品剂型来看,注射剂是2021年通过一致性评价药品的主要剂型,共计879个品规,占比44.57%;其次是片剂,共824个品规,占比41.79%(详见图2)。近3年来过评药品剂型中注射剂占比也呈现出持续上升态势,由2019年的5%增长到2021年的近45%(详见图3)。
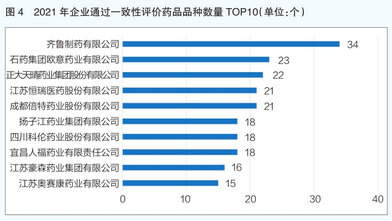
从企业过评方面来看,2021年共有571家企业申报的药品通过一致性评价,其中过评药品品种数量最多的企业是齐鲁制药有限公司,共过评34个药品品种(详见图4)。
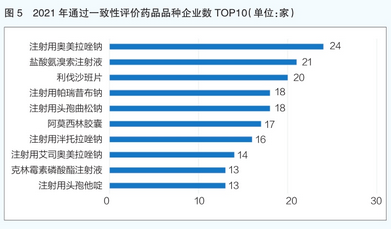
从同一品种通过一致性评价的企业数量来看,2021年通过一致性评价企业数最多的药品品种是注射用奥美拉唑钠,共有24家企业产品通过一致性评价(详见图5)。该品种为2018年版国家基药目录品种及2020年国家医保乙类品种,用于在治疗十二指肠溃疡、胃溃疡、反流性食管炎及Zol l i nger-El l i son综合征的过程中,口服疗法不适用时的替代疗法。注射用奥美拉唑钠至今已在临床应用超过20年,疗效确切,安全性高,市场规模大,药物经济学优势明显,因此该品种过评企业竞争较为激烈。
过评药品纳入多批次集采保障人民用药安全性可及性
2016年发布的《关于开展仿制药质量和疗效一致性评价的意见》明确,对通过一致性评价的药品品种,在医保支付方面予以适当支持,医疗机构应优先采购并在临床中优先选用。同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。此外,2019年发布的《关于国家组织药品集中采购和使用试点扩大区域范围的实施意见》指出,仿制药质量入围标准原则上以通过质量和疗效一致性评价为依据。一致性评价成为仿制药入围带量采购的基本门槛。
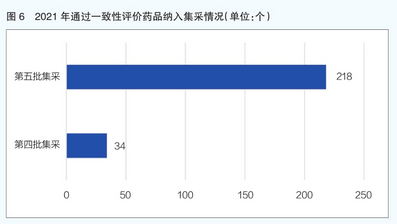
在2021年的过评药品中,共有252个品规的药品被纳入国家药品集采名单,占比12.78%。其中,有218个品规的药品纳入第五批国家药品集采名单,34个纳入第四批国家药品集采名单(详见图6)。
2021年,仿制药质量和疗效一致性评价工作的顺利推进,为国家药品集中带量采购提供了有力支撑。
(中国健康传媒集团舆情监测中心 王文昊)
(以上信息来源于医药网)

 琼公网安备 46010602000893号
琼公网安备 46010602000893号
