医药网7月30日讯 7月23日,NMPA官网发布最新一批药品获批信息,阿兹夫定片获批上市,成为今年以来第七个获批上市的全身用抗感染药物1类新药。数据显示,在限输限抗、集采、疫情轮番施压下,中国公立医疗机构终端昔日TOP1大类全身用抗感染药物的市场规模在2020年迎来首跌,销售额跌破2000亿元。随着国产新药上市,有望助力市场格局洗牌,今年已过大半,还有哪些新药值得期待?
今年第七个1类新药获批,千亿市场再现生机
表1:2021年至今获批上市的全身用抗感染药物1类新药(按批文日期统计)
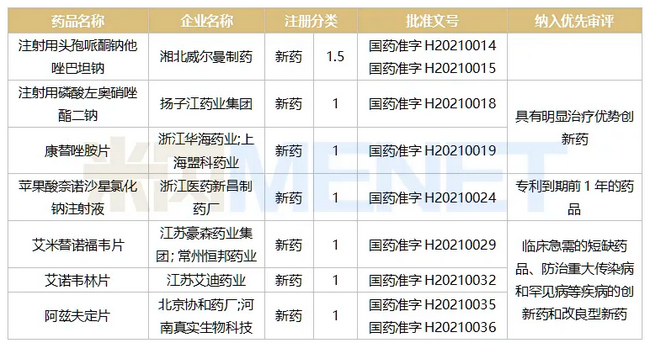
来源:米内网MED2.0中国药品审评数据库
注:新适应症获批不纳入统计范围
米内网数据显示,2021年至今共有7个全身用抗感染药物1类新药获批上市,集中在全身用抗细菌药(3个)、全身用抗病毒药(3个),而全身用抗真菌药占1个。除了注射用头孢哌酮钠他唑巴坦钠外,其余6个均被纳入了优先审评。
注射用磷酸左奥硝唑酯二钠为硝基咪唑类抗生素,用于预防和治疗厌氧菌感染,是扬子江首个国产化药1类新药;康替唑胺片是新一代噁唑烷酮类创新药,被誉为“超级抗菌药”。这两个创新药因具有明显治疗优势,被纳入了优先审评,加快了上市进程。
近年来,国家层面加大了对重大传染病的防治工作,一些相关领域的创新药得到了优先审评的红利。豪森的艾米替诺福韦片是新一代的抗病毒药,用于慢性乙型肝炎成人患者的治疗;艾诺韦林片是首个抗艾滋病1类新药,用于治疗成人HIV-1感染初治患者;本次获批上市的阿兹夫定片也是抗艾口服创新药,用于与核苷逆转录酶抑制剂及非核苷逆转录酶抑制剂联用,治疗高病毒载量的成年HIV-1感染患者。
苹果酸奈诺沙星氯化钠注射液是一种新型无氟喹诺酮类抗生素。注射用头孢哌酮钠他唑巴坦钠则是早前未在国内外上市销售的新型复方制剂。
今年6月30日,国家医保局发布了《2021年国家医保药品目录调整工作方案》和《2021年国家医保药品目录调整申报指南》,标志着2021年医保目录调整工作正式拉开帷幕,其中提到了2016年1月1日至2021年6月30日期间,经NMPA批准上市的新通用名药品,可以纳入2021年药品目录评审范围……从获批时间来看,除了阿兹夫定片,其余6个1类新药有望借助医保的力量快速进入市场。
44个产品已纳入国家集采,抗细菌药占比超六成
国家集中带量采购目前已完成五批六轮,超过200个产品被纳入目录,从大类来看,全身用抗感染药物最多,达44个,且每一批次均有涉及。如此“重锤”之下,市场承压不可避免,同时也为新药进入市场腾出了空间。
表2:前五批国采纳入的全身用抗感染药物
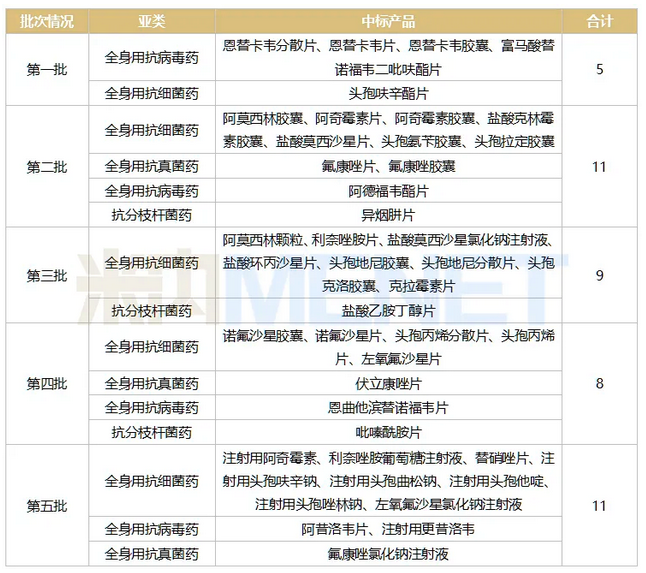
来源:米内网MID药品索引综合数据库
从亚类情况来看,全身用抗细菌药共占29个,比例达65.91%。第一批仅有头孢呋辛酯片,第二至第五批分别中标7个、8个、5个、8个;从剂型来看,第三批纳入了首个注射剂,第五批纳入的注射剂增至7个。注射是全身用抗细菌药占比最大的用药途径(2020年为82.29%),随着越来越多的注射剂产品过评或视同过评,未来预计会有更多全身用抗细菌注射剂加入到集采阵营,市场受到的冲击也将越来越大。
表3:2020年中国公立医疗机构终端全身用抗细菌药TOP5注射剂品种
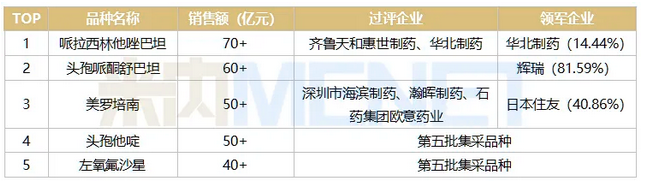
来源:米内网中国公立医疗机构终端竞争格局
2020年全身用抗细菌药TOP5注射剂均为超40亿元的大品种,其中有2个已被纳入国采。注射用哌拉西林钠他唑巴坦钠目前已有2家国内药企过评,领军企业为华北制药,注射用美罗培南目前已有3家国内药企过评,日本住友领军市场,两个大品种会否进入下一批目录,值得继续观察。
已纳入国采的全身用抗病毒药有8个,第五批纳入了首个注射剂产品。从用药途径来看,内服产品依然是主流,2020年占比接近八成份额,注射的市场份额则持续走高。
表4:2020年中国公立医疗机构终端全身用抗病毒药内服TOP5品种
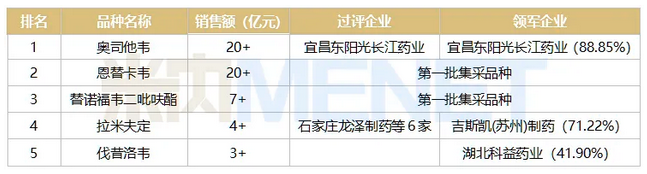
来源:米内网中国公立医疗机构终端竞争格局
2020年全身用抗病毒药内服TOP5品种中2个已被纳入国采,超20亿大品种奥司他韦已有1家企业过评(胶囊剂),上海中西三维药业的胶囊剂一致性评价补充申请在审评审批中,信泰制药的磷酸奥司他韦胶囊4类仿制上市申请进入审批状态,申报干混悬剂仿制上市并在审的企业有8家……随着国内仿制药陆续获批并过评,这个大品种进入集采的倒计时也越来越近。拉米夫定是第三批流标品种,日后会否再次被纳入也值得关注。
2020年在中国公立医疗机构终端全身用抗真菌药超10亿的品种包括了伏立康唑、卡泊芬净以及氟康唑,已纳入国采的4个产品中,氟康唑包揽了3个(含内服和注射),还有1个是伏立康唑片。注射用伏立康唑目前有9家企业的4类仿制上市申请在审,而注射用醋酸卡泊芬净仅有江苏恒瑞医药过评,从目前情况来看,两大抗真菌注射剂在短期内较难触发集采机制。
已纳入国采的抗分枝杆菌药涉及异烟肼、吡嗪酰胺、乙胺丁醇,2020年在中国公立医疗机构终端品种排名中排在TOP4、TOP5和TOP7,TOP1品种利福平目前已有沈阳红旗制药以及杭州民生药业的胶囊剂过评,下一批集采会否考虑这个品种值得我们继续关注。
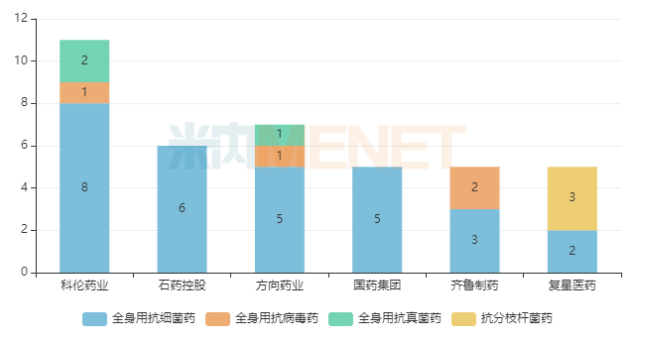
图1:前五批国采中标产品超过5个的企业集团情况
来源:米内网MID药品索引综合数据库
从中标企业(集团)来看,科伦药业合计中标11个产品,成为了全身用抗感染药物集采的排头兵。截至目前,全身用抗感染药物过评/视同过评的产品超过100个,科伦涉及21个产品,在后续开展的新集采中有望继续发挥龙头实力。
5个1类新药摩拳擦掌,20个首仿蓄势待发
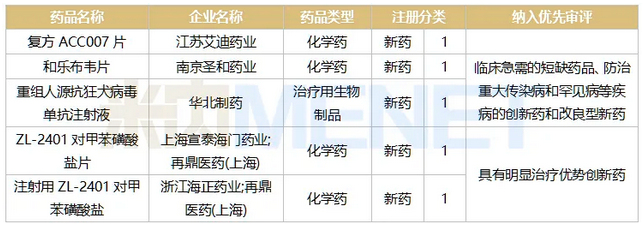
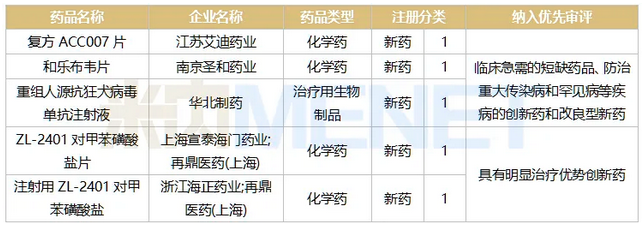
表5:2018年至今申报上市并在审的1类新药情况
来源:米内网MED2.0中国药品审评数据库
2018年至今申报上市的全身用抗感染药物新药中(不含疫苗和免疫血清和免疫球蛋白),目前在审评审批中的有12个,涉及5个1类新药。
艾迪药业的复方ACC007片是抗艾滋病领域的1类新药,公司在ACC007(艾诺韦林片)的基础上联合2个核苷类逆转录酶抑制剂(拉米夫定和替诺福韦)研发而成的国产首款三合一单片复方创新药制剂。据悉,其组合方案及药物选择符合国际趋势,在2019年12月被列入国家十三五“重大新药创制”科技重大专项。患者每天仅需服用1片,无需再服用其它抗艾滋病药物,有助于减轻患者服药负担,增加依从性,减少耐药发生。
以“临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药”为由被纳入优先审评的和乐布韦片和重组人源抗狂犬病毒单抗注射液均为全身用抗病毒药。和乐布韦片为抗HCV(慢性丙型肝炎)1类新药,也是首个国内自主研发的NS5B抑制剂,肝靶向能力强,抗病毒活性高。重组人源抗狂犬病毒单抗注射液是华北制药自主创新项目,被列为国家“重大新药创制”科技重大专项品种,其作用机制及适应症是与人用狂犬病疫苗联用,用以补充人用狂犬病疫苗主动免疫过程中的抗体空白,可直接中和体内狂犬病毒,起到被动免疫作用,用于被狂犬或其它狂犬病毒易感动物咬伤、抓伤患者的被动免疫。
以“具有明显治疗优势创新药”为由被纳入优先审评的ZL-2401对甲苯磺酸盐片和注射用ZL-2401对甲苯磺酸盐均出自再鼎医药。ZL-2401对甲苯磺酸盐是一种新型四环素,其设计旨在克服四环素耐药性,具有广谱抗菌活性,包括革兰阳性菌、革兰阴性菌、非典型病原体和多种耐药菌株,报产适应症是社区获得性细菌性肺炎(CABP)及急性细菌性皮肤和皮肤结构感染(ABSSSI)。
表6:2018年至今申报上市并在审、有望冲击首仿的产品情况
来源:米内网MED2.0中国药品审评数据库
注:*为被纳入优先审评的产品
1类新药刷爆眼球,重磅首仿不容小觑。2018年至今申报上市并在审的仿制药中,20个有望成为国内首仿。
磷酸奥司他韦干混悬剂首仿之争最为激烈,涉及8家企业,奥司他韦的领军企业东阳光药也有参与角逐,最终花落谁家,我们静待结果。此外,恩曲他滨丙酚替诺福韦的首仿之争落在了齐鲁与倍特身上,吉利德的原研产品2020年在全球的销售额超过18亿美元。超级抗生素注射用磷酸特地唑胺于2019年获批进口,目前南京正大天晴制药、瑞阳制药、扬子江药业集团正在审评审批中。
来源:NMPA官网、米内网数据库
审评数据统计截至7月27日,如有错漏,敬请指正。

 琼公网安备 46010602000893号
琼公网安备 46010602000893号
