踏入2022年,双抗研发领域接连迎来喜讯。1月5日,康方生物宣布其自主研发的凯得宁单抗(AK104)联合AK112双抗的Ib/II期临床试验申请获NMPA批准,联合或不联合化疗治疗晚期非小细胞肺癌,该临床研究是全球首个进入临床阶段的双抗+双抗联合疗法。1月6日,复宏汉霖PD-L1/TIGIT双抗HLX301临床试验申请获NMPA受理,用于多种晚期实体瘤治疗,这是国内第三款申报临床的PD-L1/TIGIT双抗。近年来,国内大分子新药研发迅速升温,双特异性抗体迎来研发热潮。目前国内大约80款双抗药物处于临床阶段,基于PD-(L)1靶点的双抗最为火热。凯得宁单抗进展最快,已处于申请上市阶段,有望一举拿下今年首款国产双抗,销售峰值将达到50亿元。
全球仅4款上市,双抗领域前景广阔
双抗药物主要是指含有两种特异性抗原结合位点的人工抗体,可以同时与靶细胞和T细胞进行相互作用,介导一系列免疫反应。与传统单抗相比,双抗优势在于拥有更加精准的靶向和更强的治疗效果,理论上双抗可以发挥“1+1>2”的作用。正是因为其巨大的治疗潜力,双抗药物前景广阔,逐渐成为新药研发和投资的“新宠”。
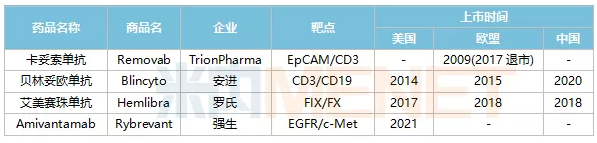
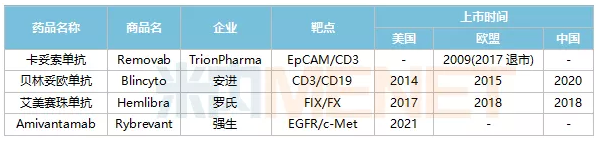
2021年5月21日,全球第4款双抗药物——强生的Amivantamab获得美国FDA上市批准,用于治疗EGFR突变的非小细胞肺癌,这距离全球首款双抗药物的上市时间已经过去超过10年。在10多年间,全球仅上市了4款双抗药物,除了强生的Amivantamab,还有TrionPharma公司的卡妥索单抗、安进的贝林妥欧单抗和罗氏的艾美赛珠单抗。其中,艾美赛珠单抗和贝林妥欧单抗分别在2018年和2020年在国内获得上市批准,这也是目前国内仅两款已上市的双抗药物。
表1:全球已上市双抗药物
国内80款在临床阶段,信达、百济神州、恒瑞等均有布局
聚焦国内双抗领域,双抗研发热潮持续。据统计,目前已有近80款双抗药物处于申报临床及以上的研发状态,超过44家国内药企参与布局。
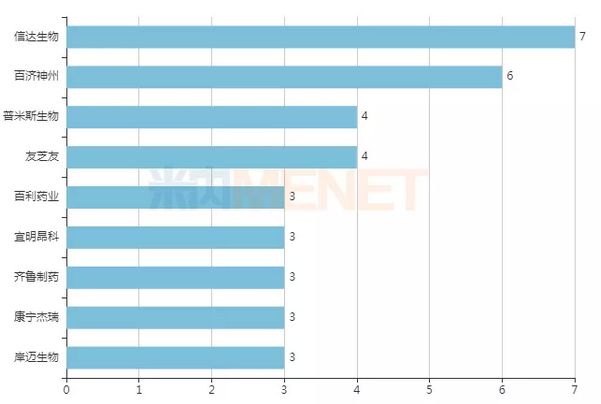
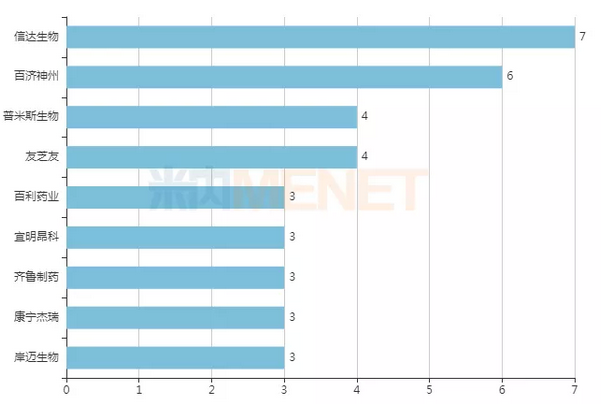
从数量来看,信达生物是双抗领域的“大户”,拥有7款处于临床阶段的双抗药物,是国内在研双抗药物最多的药企。百济神州有6款双抗处于临床阶段,1款是和Zymeworks公司合作获得,剩余5款是和安进合作引进。除此之外,处于临床阶段双抗品种超过3款的国内药企还有普米斯生物(4款)、友芝友(4款)、百利药业(3款)、宜明昂科(3款)、齐鲁制药(3款)、康宁杰瑞(3款)和岸迈生物(3款)。
图1:处于临床阶段双抗品种超过3款的国内药企
从研发进展来看,康方生物的凯得宁单抗(AK104)进展最快,2021年9月CDE同意PD-1/CTLA4双抗凯得宁单抗(AK104)申报上市,用于治疗复发或转移性宫颈癌,并给予其优先审评资格。恒瑞的PD-L1/TGFB双抗SHR-1701、康宁杰瑞的PD-L1/CTLA4双抗重组人源化PDL1/CTLA-4双特异性单域抗体Fc融合蛋白(KN046)、康方生物另一款双抗AK112、百济神州抗HER2多位点双抗ZW25、广东凌腾引入的EpCAM/CD3双抗卡妥索单抗均位于临床III期阶段。
表2:国内双抗在研情况
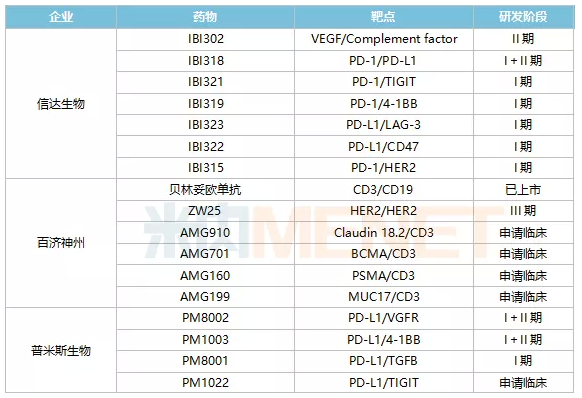
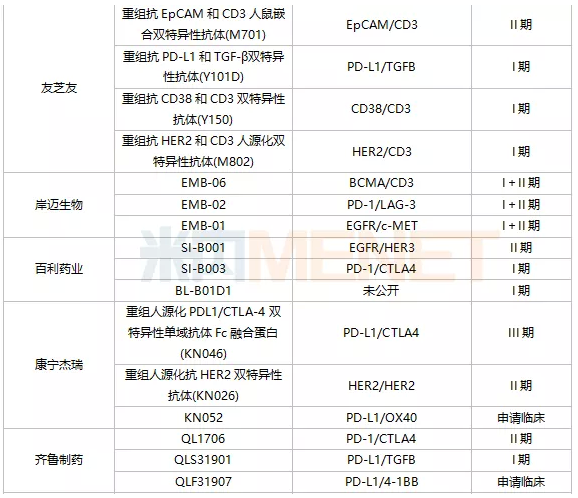
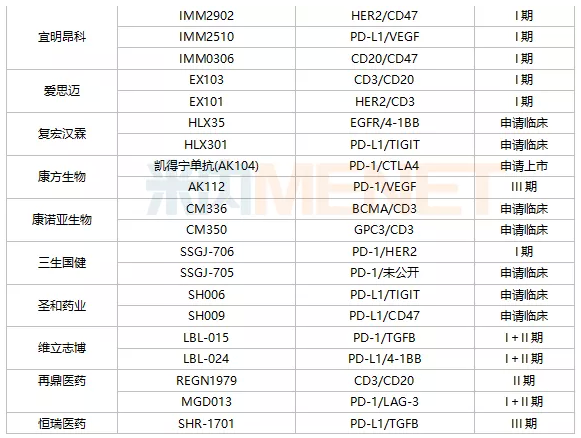
注:仅统计申请临床及以上阶段;统计日期截止2022年1月上旬
从靶点的研发热度来看,PD-L1/TGFB是国内双抗研发最热门的组合,PD-L1/TGFB双抗通过阻断PDL1和TGFB两条信号通路,既解除了体内的免疫抑制,又恢复了机体免疫杀伤能力,理论上疗效能够大于“1+1”。
目前,国内共有8款PD-L1/TGFB双抗处于临床阶段,其中进展最快的是恒瑞的SHR-1701,处于临床Ⅲ期。根据中国药品临床试验公示库,目前其已启动15项相关临床研究,非鳞非小细胞肺癌、胃癌、宫颈癌等适应症处于临床Ⅲ期。截至目前,恒瑞对相关项目累计已投入研发费用约为2.22亿元。值得一提的是,该靶点组合尚未有药品上市,原本在全球进展最快的默克M7824双抗,在2021年四项临床试验相继宣告失败了,这对恒瑞来说,或许是个弯道超车的机会,倘若能适时进行战略调整,SHR-1701有可能成为“first-in-class”。
而从单个靶点的研发热度统计,PD-(L)1是双抗领域当之无愧的靶点“社交小达人”。在78款纳入统计的双抗药物中,有16款是基于PD-1靶点的双抗,有32款是基于PD-L1靶点的双抗,共计47款双抗靶点涉及PD-(L)1靶点,超过处于临床阶段双抗药物总数量的一半,这和PD-(L)1研发热潮下药企寻求差异化的策略有关。
多方位布局,50亿双抗上市在即
凯得宁单抗(AK104)是康方生物自主研发的新型的、潜在下一代首创PD-1/CTLA4双特异性肿瘤免疫治疗药物,能同时靶向两个经过验证的免疫检查点分子:程序性细胞死亡蛋白1(PD-1)及细胞毒性T淋巴细胞相关蛋白4(CTLA4),因此已显示出PD-1及CTLA4单抗联合疗法的临床疗效以及PD-1和CTLA4单抗联合疗法无法提供的良好安全性。
据米内网新版全球新药研发库数据,凯得宁单抗的研发版图不局限于国内,在美国、澳大利亚、新西兰也开展多项临床试验,在研适应症涉及多种瘤种,包括宫颈癌、胃癌、食管癌、肾细胞癌、非小细胞肺癌、腺癌、淋巴癌、实体瘤、乳腺癌、鳞状细胞癌、黑色素瘤、肝细胞癌、鼻咽癌等。在国内,凯得宁单抗已开展超过13项临床试验,其中于2020年中国肿瘤免疫会议上披露凯得宁单抗治疗复发或转移性宫颈癌的临床试验结果显示,客观缓解率(ORR)达47.6%,与PD-1单药或CTLA4联合用药相比,疗效上出现显著提升。
基于其临床试验的优越表现,2021年9月26日,CDE已经同意康方生物递交凯得宁单抗治疗复发或转移性宫颈癌的新药上市申请,并给予优先审评资格。凯得宁单抗有望于2022年获批,并收获“first-in-class”、全球首款PD-1/CTLA4双抗、首款国产双抗等一系列重磅头衔。据券商预计,凯得宁单抗的销售峰值有望达到50亿元。
图3:凯得宁单抗具体布局


来源:新版全球新药研发库
数据预测显示,随着全新双抗进入市场,同时已上市双抗获批更多适应症,双抗的全球市场规模在2025年将超过500亿元。近年,我国创新药研发迎来新的高潮,在康方生物、康宁杰瑞、恒瑞医药等龙头企业的引领下,双抗药物研发呈现出千帆竞技、百舸争流的热闹景象。首个国产双抗药物上市在即,但伴随而来的商业化风险也不容小觑,如何调整策略,规避风险是康方生物的课题。而在双抗赛道上的后来选手,更要注重的是减少同质化竞争、寻求产品差异化,这样才有赶超前者的机会。
资料来源:公开资料、米内网数据库、公司公告
如有疏漏,欢迎指正!
(以上信息来源于医药网)

 琼公网安备 46010602000893号
琼公网安备 46010602000893号
